Unidad 2
Formula empírica y molecular
. . FORMULA EMPÍRICA
Para hallar la fórmula empírica de un compuesto, primero se obtienen los moles de cada elemento, luego se divide cada uno por el de menor valor y finalmente, por simplificación, se hallan los números enteros más sencillos posibles.

FORMULA MOLECULAR
La fórmula molecular expresa el número real de átomos que forman una molécula a diferencia de la fórmula química que es la representación convencional de los elementos que forman una molécula o compuesto químico.
Ejemplo:
C4OH10
- ¿como se calcula?
Determinación de la fórmula empírica y molecular de la cortisona
La composición centesimal de la cortisona es: 69,96 % de C; 7,83 % de H y 22,21 % de O. Determinar la fórmula empírica. Sabiendo que la masa molecular es 360,43 obtener la fórmula molecular.
1. Dividir los porcentajes en masa por la masa atómica del elemento.
2. Dividir los resultados anteriores entre el más pequeño.
3. Si los valores anteriores no son enteros se multiplican por un factor que lo convierta en enteros. En este caso el factor es 5.
4. Escribimos la fórmula empírica (C21H28O5)n
El parámetro n se determina dividiendo la masa molecular del compuesto entre la masa molecular de la fórmula empírica
5. Escribimos la fórmula molecular C21H28O5
- vídeo para ampliar información:
Formulas estructurales
La fórmula estructural de un compuesto químico es una representación gráfica de la estructura molecular, que muestra cómo se ordenan o distribuyen espacialmente los átomos. Se muestran los enlaces químicos dentro de la molécula, ya sea explícitamente o implícitamente.
Entre ellas encontramos:
FORMULA CONDENSADA Las fórmulas condensadas son las moleculares, es decir, las que indican el nº de átomos de cada elemento que forman la molécula. Por ejemplo, para el propano se pueden plantear la fórmula semidesarrollada, que indica cómo están unidos los átomos, o la condensada, que sólo indica proporciones.
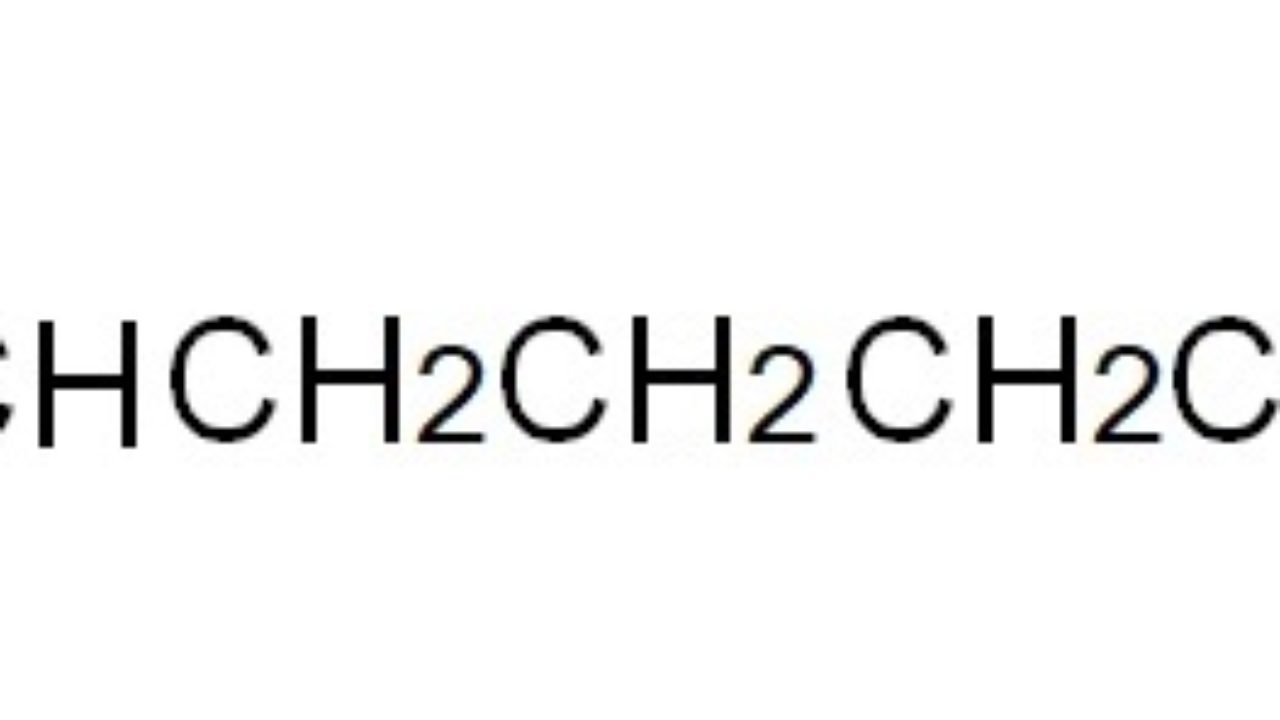
FORMULA DESARROLLAS
Es el paso siguiente en complejidad de la semidesarrollada, indicando el enlace y la ubicación de cada átomo del compuesto dentro de sus respectivas moléculas.
Ejemplo:

FORMULA SEMI-DESARROLLAS
Muestra todos los átomos que forman una molécula covalente, y los enlaces entre átomos de carbono. Es posiblemente la fórmula química más empleada en química orgánica aunque no permite ver la geometría real de las moléculas.
Ejemplo:
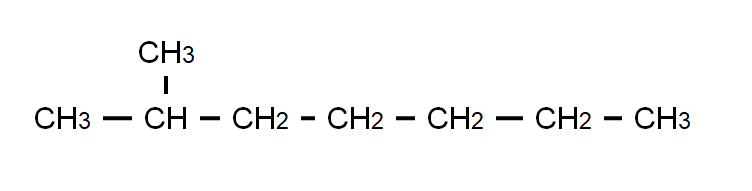
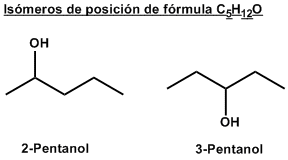
FORMULA DE LINEAS
Su representación es en forma de zig-zag, las lineas representan enlaces y los vértices los átomos de carbonos.
Ejemplo:
. CADENAS CARBONADAS
Una cadena carbonada es el esqueleto de prácticamente todos los compestos organicos y está formada por un conjunto de varios átomo de carbono, unidos entre sí mediante enlace covalente carbono-carbono y a la que se unen o agregan otros átomos como hidrogeno, oxigeno o nitrogeno, formando variadas estructuras, lo que origina infinidad de compuestos diferentes.

Clasificación de lo hidrocarburos
Solo tienen átomos de carbono e hidrógeno, a continuación un mapa mentar en como es que se dividen:
Hidrocarburos
|
|-----------------------------------|
Alifáticos Aromáticos
| |
Anillo benceno
|------------------------| 

Saturados Instaurados
| |
enlaces simple enlaces doble o triple
| |
alcanos |-------------|
alquenos alquinos
Alifáticos: se define como calificar a aquellos compuestos orgánicos que disponen de una cadena abierta como estructura de sus moléculas.
Aromáticos: es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π.
. GRUPOS FUNCIONALES
Las moléculas orgánicas se componen de una cadena hidrocarbonada en la que se insertan o se unen unos grupos especiales que pueden poseer átomos diferentes de carbono e hidrógeno heteroátomos.
Estos grupos de átomos 'especiales' se denominan grupos funcionales.
Una de tus primeras tareas al adentrarte en la Química Orgánica es el reconocimiento e identificación de los diversos grupos funcionales.
Estos grupos de átomos 'especiales' se denominan grupos funcionales.
Una de tus primeras tareas al adentrarte en la Química Orgánica es el reconocimiento e identificación de los diversos grupos funcionales.

Buen orden de información, colocar más ejemplos. Además recuerde que cada unidad debe ser colocada como página en el blog no solo como entrada
ResponderEliminar